Essais phenotypiques
Essais phénotypiques
Les divers traitements infligés aux cellules en laboratoire soit par transfection ou par des drogues ont souvent des impacts phénotypiques plus ou moins importants, que ce soit au niveau de la prolifération, de la viabilité, de l’apoptose, une perturbation du cycle cellulaire et pour les cellules issues de lignées cancéreuses, un effet sur leur potentiel métastatique.
La plateforme RNomique met son expertise à votre disposition en offrant un éventail de services d’analyses phénotypiques de façon à quantifier et caractériser ces effets sur des cellules vivantes ou fixées.
Plusieurs appareils à notre disposition permettent de réaliser des essais de façon à visualiser les effets phénotypiques d’un traitement donné en continue (XCELLigence), par intervalles plus ou moins rapprochés (CloneSelect) où à la fin d’une période déterminée (ImageXpress).
Voici une liste des nouveaux essais offerts par la Plateforme :
- Essais de prolifération / compte cellulaire
- Essais de viabilité
- Essais d’Apoptose
- Multiplex
- Essais de Migration / Invasion
- BrdU (5-bromo-2'-désoxyuridine)
- Essai de cycle cellulaire
Essais de prolifération / compte cellulaire
Il s’agit d’un compte cellulaire. Les cellules sont ensemencées dans des plaques 96 puits puis traitées (transfection). Après la durée souhaitée du traitement, les cellules sont colorées au Hoechst (Invitrogen Corporation) puis des images sont acquise avec le microscope ImageXpress. Les cellules positives sont comptées et comparées aux cellules contrôles. Le Hoechst peut-être utilisé en combinaison (multiplex) avec d’autres fluorophores (voir essais de viabilité et apoptose ci-bas).
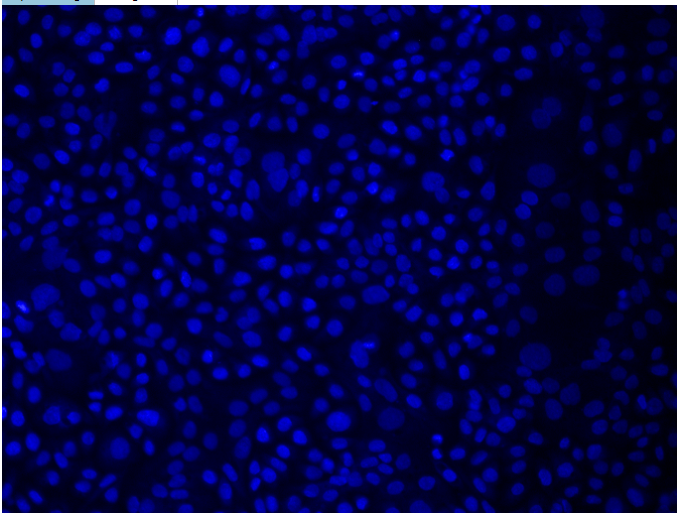 Hoechst
Hoechst
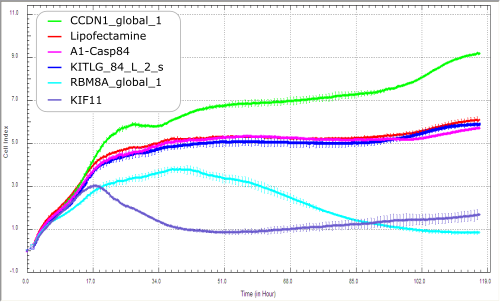
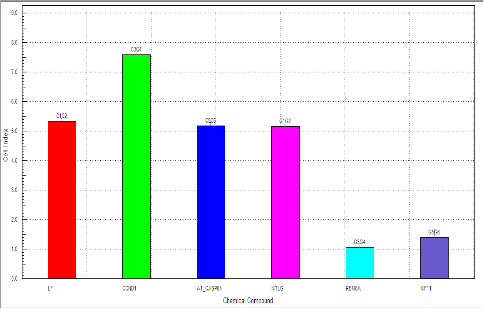
Alternativement, on peut utiliser l’appareil XCELLigence (ACEA) avec ses E-plates (16 puits/ plaque) pour visualiser les courbes de croissance en temps réel de cellules traitées ou non sans fluorophore.


Essais de viabilité
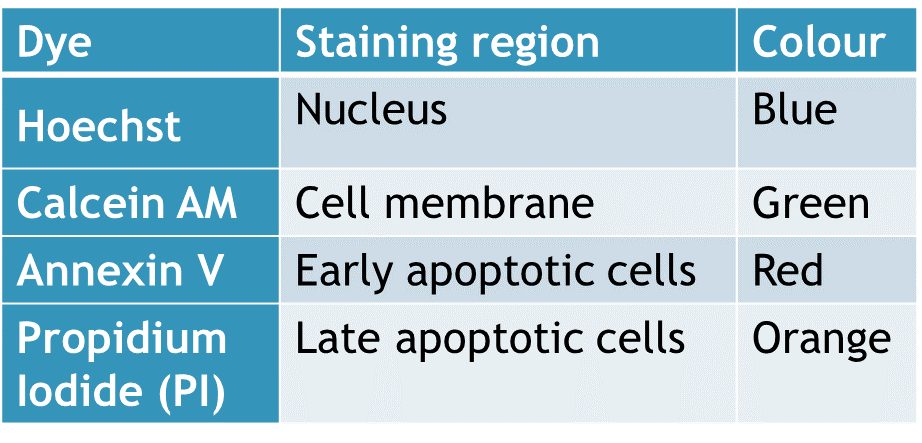
La viabilité (ou perte de viabilité) des cellules est évaluée en utilisant du propidium Iodide (PI) (Invitrogen Corporation) en combinaison avec Hoechst. Le Hoechst colore tous les noyaux cellulaires alors que le PI ne colore que les cellules mortes de nécrose ou en fin d’apoptose. Les cellules sont traitées (transfection), colorées puis des images sont acquises en microscopie (Operetta ou Image Xpress) où le pourcentage de cellules mortes est déterminé (Cellules PI positives sur total de cellules colorées avec Hoechst).
Essais d’Apoptose
Le marqueur utilisé pour L’apoptose est l’Annexin-V Alexa fluor 647 (invitrogen Corporation). Cette molécule détecte la translocation de phosphatidyl-serine (PS) de la face interne de la membrane (indétectable) pour des cellules saines vers la surface externe des cellules apoptotiques. Les cellules sont traitées (transfection), colorées puis des images sont acquises en microscopie (Operetta ou Image Xpress) où le pourcentage de cellules apoptotiques est déterminé (Cellules positives pour Annexin-V comparativement au total de cellules colorées avec Hoechst).
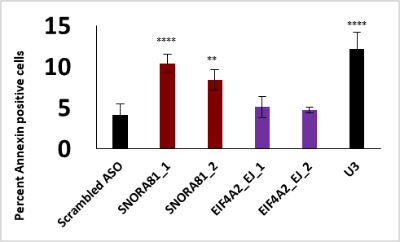
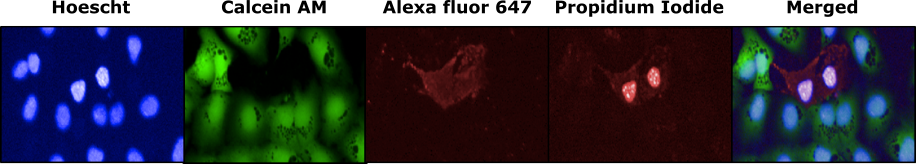
Multiplex
En combinant les fluorophores ci-haut mentionnés, on peut faire tous ces essais à la fois sur les mêmes cellules, en une seule acquisition d’images au microscope.
Essais de Migration / Invasion
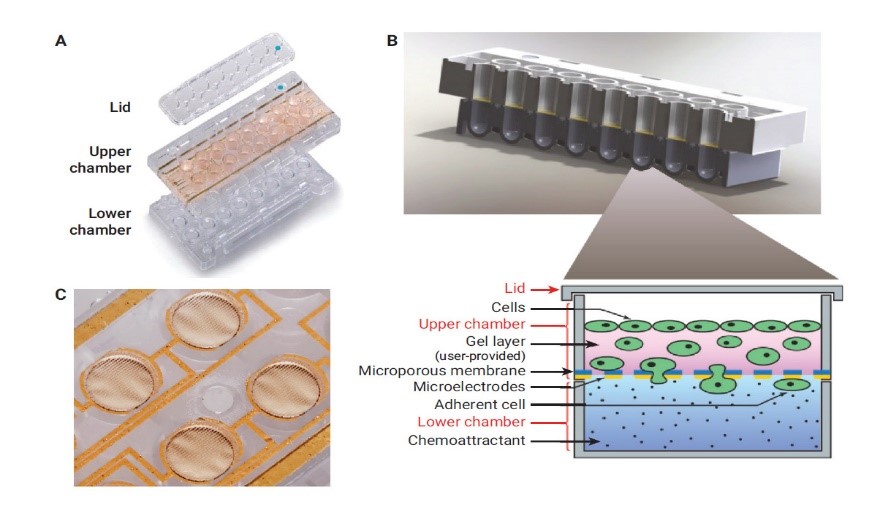
À l’aide de l’appareil XCELLigence (ACEA) et de plaques CIM-plates, on peut visualiser la vitesse de migration ou d’invasion des cellules. Les CIM-plates sont des plaques de 16 puits constituées de 3 parties chacune (couvercle, chambre supérieure et chambre inférieure) se comportant comme des chambres de Boyden électroniques et permettent de mesurer les mouvements cellulaires entre la chambre supérieure et la chambre inférieures pour chacun des 16 puits.
L’essai de migration utlise le serum bovin fetal (FBS) comme chimioattractant. Les cellules ensemencées dans la chambre supérieure avec un milieu sans serum vont migrer vers la chambre inférieure contenant du milieu additionné de serum en traversant la membrane microporeuse munie de biocapteurs. Ces biocapteurs détectent une différence de courant électrique lorsque des cellules y adhèrent permettant de mesurer le mouvement des cellules.
L’essai d’invasion consiste essentiellement en un essai de migration à la différence qu’une couche de Matrigel recouvre la surface des puits de la chambre supérieure de façon à imiter une couche de cellules épithéliales laquelle doivent traverser les cellules invasives.
BrdU (5-bromo-2'-désoxyuridine)
Cet essai permet de discriminer entre un phénotype de prolifération ou d'adhésion lorsqu’une réduction du compte cellulaire est observée. Un pourcentage de cellules positives au BrdU similaire à celui du contrôle négatif indique un phénotype d’adhésion alors qu’un pourcentage différent du contrôle indique plutôt un phénotype de prolifération. À la fin d’un traitement au choix (e.g.transfection) pour une période déterminée, les cellules sont traitées avec 0,75mM BrdU (Calbiochem) pendant 1,5h. les cellules sont ensuite fixées et perméabilisées directement dans la plaque 96 puits avec de la paraformaldéhyde 3,7% (sigma) et 0,1% de Triton X-100 (VWR). Un essai d’immunofluorescence avec un anticorps anti-Bromodeoxyuridine ( GeneTex Inc) suivi d’un anticorps secondaire couplé à une molécule fluorescente (Alexa fluor 488, Invitrogen) est réalisé puis acquisition d’images avec ImageXpress (Molecular Devices).
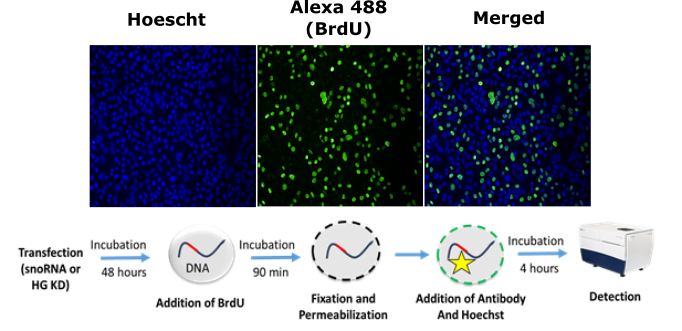
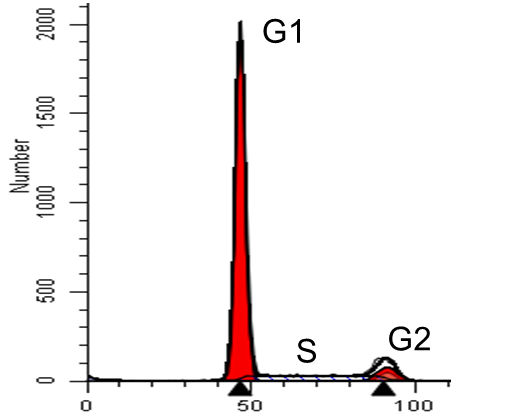
Essai de cycle cellulaire
L’analyse des phases du cycle cellulaire peut se faire en utilisant le Propidium Iodide (PI) sur des cellules fixées à l'éthanol.
Les cellules sont récoltées après un traitement au choix (e.g. transfection) d’une durée déterminée, centrifugées puis lavées avec du PBS (wisent). Les cellules sont ensuite traitées avec un tampon H (20mM HEPES, pH 7.2; 0.16M NaCl; 1mM EGTA contenant 0.05% Triton X-100 0.05%) de façon à provoquer la décondensation de la chromatine. Après 30 minutes de coloration avec du PI 10mg/ml, les cellules sont passées au cytomètre de flux (FACS).
Pour plus d'informations sur l'un de ces tests, veuillez nous contacter.
